Czy bakterie lubią czekoladę?
Z nauką jest trochę tak, jak z poszukiwaniem przygód. Masz ustabilizowane życie, wykonujesz codziennie swoje obowiązki, czasem nawet odnosisz wrażenie, że nic się nie dzieje i tak już pozostanie. Ale spróbuj tylko wychylić nos poza swoje podwórko, a naukowa przygoda dopadnie cię na pierwszym zakręcie. Tak właśnie było ze mną. Na moją pierwszą podróż w nieznane czekałam w dwudziestostopniowym mrozie, bo przeznaczenie, w postaci autokaru do Danii, spóźniało się dobre 4 godziny. Pierwszy raz wyjeżdżałam za granicę na dłużej niż dwa tygodnie i, co tu kryć, byłam przerażona. Na szczęście nie sama. Było nas troje.
„Ty, zobacz, wiedziałaś?” – Łukasz pukał mnie nerwowo w ramię za każdym razem, kiedy znalazł w czytanym artykule jakąś nową informację. Dla mnie zdobywanie nowej wiedzy zaczęło się właściwie już od samego tytułu. Haemophilus parainfluenzae. Tak, coś kiedyś słyszałam o takiej bakterii, ale to był influenzae, skąd ta para– na początku? Jakaś pomyłka w druku? Taką nazwę mikroorganizmu przeczytałam w tytule widniejącym na okładce cienkiej książeczki zawierającej wszystko, co student zaczynający pracę w laboratorium mikrobiologii medycznej powinien wiedzieć o obiekcie badań. Za oknem padał śnieg z deszczem, a my, w co najmniej wiosennych nastrojach, zaczynaliśmy wycieczkę po laboratorium. Tam było wszystko na wyciągnięcie ręki, można było wszystkiego dotknąć. Mało tego, można było tego użyć i nie słyszeć: „Uważaj! Nie ruszaj, bo to drogie!”. Po prostu raj. Sam profesor oprowadzał nas po swoim królestwie, pokazując, w jaki sposób czego używać. Po ponaddwugodzinnej wędrówce każde z nas udało się do akademika obciążone sporą ilością makulatury do weekendowego czytania. Od tego się zawsze zaczyna.
Kolorowe komórki
Był poniedziałek, a ja miałam wrażenie, że znam tego obrzydliwego Haemophilusa od urodzenia. Dosłownie, ponieważ ta bakteria żyje sobie w zgodzie z nami od momentu naszego pojawienia się na świecie. Szczególnie obficie występuje na błonach śluzowych jamy ustnej i gardła. Niby niegroźna, a jednak okazuje się, że w sprzyjających warunkach może spowodować zapalenie gardła, płuc, a nawet opon mózgowych! Krótko mówiąc, hodujemy sobie żmiję na własnym łonie – myślałam ze złością, czytając informację o kolejnym udokumentowanym przypadku zapalenia płuc u dzieci, spowodowanym tą „niewinną” bakterią.
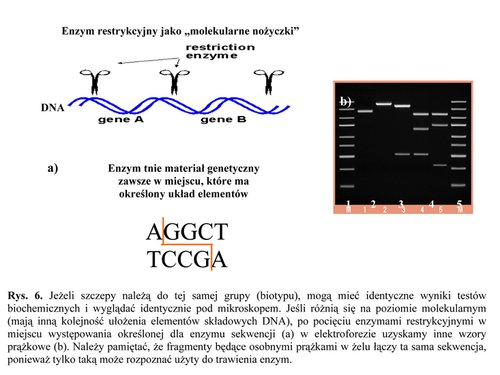
Jeżeli szczepy należą do tej samej grupy (biotypu), mogą mieć identyczne wyniki testów biochemicznych i wyglądać identycznie pod mikroskopem. Jeśli różnią się na poziomie molekularnym (mają inną kolejność ułożenia elementów składowych DNA), po pocięciu enzymami restrykcyjnymi w miejscu występowania określonej dla enzymu sekwencji (a) w elektroforezie uzyskamy inne wzory prążkowe (b). Należy pamiętać, że fragmenty będące osobnymi prążkami w żelu łączy ta sama sekwencja, ponieważ tylko taką może rozpoznać użyty do trawienia enzym.
Plan był taki: pobiera się wymazy z gardła, języka i wewnętrznej strony policzka patyczkiem do wymazów. Tak uzyskany materiał bakteriologiczny wkłada się następnie do płynnej pożywki, która pozwala na wypłukanie mikroorganizmów, dzięki czemu otrzymujemy zawiesinę nieuszkodzonych komórek. Potrzebne są nam żywe bakterie, aby wysiać je na zamykane naczynko zwane płytką Petriego, zawierające tzw. podłoże selektywne. O co chodzi? Bakteria, żeby rosnąć, potrzebuje pokarmu, tak jak my. Podłoża są mieszaniną niezbędnych dla niej składników pokarmowych. Jeżeli użyjemy podłoża, na którym rośnie większość bakterii, niewiele osiągniemy, ponieważ w eksperymencie interesuje nas konkretny gatunek. Musimy więc przeprowadzić selekcję mikroorganizmów, czyli dodać do podłoża takie składniki, które umożliwią wzrost badanym bakteriom, hamując jednocześnie rozwój wszystkich innych.
„Tego się nie je!” – dostałam po łapach od Tove, naszej techniczki, w chwili, gdy próbowałam – jak na prawdziwego czekoladoholika przystało – wsadzić palec w sterylną płytkę, na której smakowicie połyskiwała ni mniej ni więcej tylko roztopiona Milka. Okazuje się, że podłożem do izolacji Haemophilus parainfluenzae jest agar czekoladowy. No proszę, kto by pomyślał, że bakterie też lubią czekoladę! Nazwa tego medium pochodzi od smakowitego wyglądu, na który dałam się nabrać. Do podłoża dodaje się krew wołową, która jest źródłem niezbędnych do rozwoju tych bakterii aminokwasów. Całość pożywki zestala się agarem, substancją, która po podgrzaniu jest płynna, ale w temperaturze pokojowej przemienia się w ciało stałe. Komórki krwi są tu jednak rozbite w wyniku ich podgrzania, przez co podłoże przybiera barwę brązową, co na gładkiej agarowej płytce wygląda jak czekolada. Uzyskaną zawiesinę bakterii trzeba wysiać na medium. W tym celu umieszcza się objętość płynu, porównywalną z główką zapałki, na agarze i rozmazuje równomiernie po jego powierzchni. Płytki hoduje się w temperaturze nieco niższej od temperatury ciała, ponieważ w ustach ciągle robimy sobie przeciągi mówiąc, jedząc czy ziewając. Ale to nie koniec, ponieważ aby uzyskać pewność, że pracujemy na czystym szczepie, czyli tylko jednym gatunku bakterii, należy przesiać pojedyncze kropeczki bakterii zwane koloniami, na czyste płytki z agarem, używając metalowego drucika zwanego ezą. Z reguły po dwukrotnym powtórzeniu procedury możemy mieć pewność, że uzyskaliśmy czystą hodowlę.
Po uporaniu się z posiewami przyszedł czas na mikroskop. Żeby dostrzec bakterie w mikroskopie świetlnym, należy odpowiednio wybarwić ich struktury. Pod koniec XIX wieku duński uczony Gram opracował stosowaną do dziś metodę barwienia bakterii. Jak to zrobił? Otóż wiedział, że ściana komórkowa bakterii zbudowana jest ze związku zwanego mureiną. Jak się okazało, związek ten może budować dwa różne w strukturze rodzaje ścian – bardzo grubą, w której skład wchodzą tylko łańcuchy mureiny lub dużo cieńszą, też mureinową, ale leżącą w przestrzeni pomiędzy wewnętrzną i zewnętrzną błoną, które chronią ją przed wpływem niekorzystnych czynników. Różnice w budowie ściany narzucają różną reakcję na barwniki, którymi na nią działamy. Uczony potraktował mieszaninę bakterii na szkiełku mikroskopowym barwnikiem o nazwie fiolet krystaliczny, ale ponieważ w komórkach chronionych zewnętrzną błoną mureina jest ukryta, barwnik nie przyłączył się do łańcuchów tego związku i nie zabarwił komórki na fioletowo. Tylko grubościenne komórki bez dodatkowych osłon uzyskały fioletowe zabarwienie. Dopiero kiedy wypłukał mieszaninę alkoholem i potraktował barwnikiem o innej strukturze chemicznej, zwanym fuksyną, uzyskał zabarwienie komórek, w których mureina była dodatkowo chroniona. Tak udało mu się dokonać obowiązującego do dziś podstawowego podziału bakterii na gramdodatnie, czyli te, które barwią się na fioletowo, i gramujemne, które uzyskują kolor różowy dopiero po zadziałaniu na nie fuksyną. Dzięki temu najpowszechniej stosowanemu barwieniu możemy zobaczyć kształt bakterii. Idąc śladem Grama postanowiłam również obejrzeć moją językową florę bakteryjną. Ubrudziwszy zlew i siebie wszystkimi możliwymi barwnikami popędziłam do mikroskopu. No proszę, gramujemne, bo różowe, i do tego pałeczki. Mam już podstawowe wyniki identyfikacji. Czas na testy biochemiczne.
Dziwaczny biotyp
Identyfikacja biochemiczna opiera się na właściwościach metabolicznych bakterii. Mówiąc prościej, każda bakteria karmi się jedynie określonymi związkami chemicznymi i w zależności od kombinacji takich „dań” można utworzyć profil biochemiczny gatunku. Nie powinno nas to dziwić, ponieważ już 150 lat temu Anthelme Brillar−Savarin napisał: „Powiedz mi, co jesz, a powiem ci, kim jesteś”. Z bakteriami jest tak samo. W probówkach podajemy im różne rodzaje substancji, będące potencjalnymi „przysmakami”, mieszając je jednocześnie z barwnikami, aby obserwować po zmianie koloru, czy bakteria „zjada” użyty w teście związek. Jeśli następuje zmiana barwy płynu w probówce, test ma wynik dodatni, jeśli mieszanina pozostaje nietknięta, analiza jest ujemna. Jeśli nie mamy zupełnie pojęcia, z jakim mikroorganizmem mamy do czynienia, identyfikacja opiera się na dziesiątkach testów. W naszym eksperymencie wystarczyły cztery analizy, by potwierdzić „tożsamość” badanych organizmów i przyporządkować je do biotypu, podgrupy wewnątrz gatunku.
Nie wyobrażacie sobie, ile czasu zajmowało nam przygotowanie tych wszystkich probówek, korków, barwników i podłoży. Ale się opłacało. Po dwóch tygodniach przelewania, przesiewania, hodowania i sprawdzania testów uzyskaliśmy pierwsze interesujące wyniki. Znaleźliśmy biotyp, który nie pasował do żadnego opisu. Prawdziwa gratka dla mikrobiologa! Nietypowe szczepy przesialiśmy na krwisty agar. W odróżnieniu od agaru czekoladowego, komórki krwi w tym medium nie zostały wcześniej rozbite, dlatego agar ma żywy czerwony kolor. Po co takie kombinacje? Otóż na agarze z rozbitymi komórkami krwi nie możemy obserwować tzw. hemolizy, czyli rozpadu czerwonych ciałek krwi w wyniku działania różnych czynników (w tym przypadku toksyn bakteryjnych). Jeśli interesuje nas, czy badane bakterie są groźne dla zdrowia, musimy sprawdzić ich zdolność do powodowania takich objawów. Okazało się, że ten „dziwny Haemophilus” biotyp V ma zdolności hemolityczne, co objawiało się tworzeniem bezbarwnych stref agaru wokół kolonii bakterii. Kto wie, może ten szczep jest odpowiedzialny za zapalenie płuc tych biednych dzieci, o których czytałam? Trzeba to koniecznie sprawdzić. Tylko jak?
Żelki pod prądem
Nasz profesor zastał nas w pokoju w pozach myślicieli, wiszących nad zeszytami pełnymi notatek. Próbowaliśmy znaleźć metodę, która pozwoli nam sprawdzić, czym różni się biotyp V typowy od nietypowego. Po wysłuchaniu obszernego raportu, profesor powiedział tylko jedno zdanie: „Zajrzymy tym bakterzyskom w DNA”. Jak to w DNA? – pomyślałam z przerażeniem, ponieważ wtedy nie miałam pojęcia, jak się to robi i do tego niecały miesiąc wcześniej nauczyłam się obsługiwać automatyczną pipetę. Ale w dzisiejszej biologii bez analiz materiału genetycznego się nie obejdzie. Na szczęście dla chcącego nic trudnego. Profesor kazał nam namnożyć te dziwne szczepy w płynnej pożywce i zwirować tak, żeby uzyskać kuleczkę osadu bakterii na dnie probówki. Taki osad następnie trzeba było zawiesić w specjalnym agarze. Mieszaninę bakterii i agaru umieszcza się w foremkach wielkości drażetek gumy do żucia i otrzymuje się coś w rodzaju przeźroczystych żelek Haribo, zawierających całe komórki bakterii. Po co? Nic prostszego. Jeśli chce się badać materiał genetyczny (DNA−kwas dezoksyrybonukleinowy) czystego szczepu, należy unieruchomić całe komórki właśnie w takiej żelce. Ułatwia to procedury „odzierania” DNA znajdującego się we wnętrzu komórki z osłon i czyszczenia go z resztek komórkowych za pomocą serii płukań w różnych związkach chemicznych. Otrzymujemy w ten sposób oczyszczony DNA unieruchomiony agarozą.
Jak wiadomo, DNA składa się z 4 rodzajów cegiełek, które ułożone w różnej kolejności tworzą długie nici. Żeby porównać, czy kolejność ułożenia tych cegiełek różni się w przypadku bakterii identycznych na pierwszy biochemiczno−mikrobiologiczny rzut oka, trzeba je pociąć enzymami restrykcyjnymi. Te enzymy, to nic innego, jak molekularne nożyczki, które rozpoznają określony tylko dla siebie układ elementów składowych DNA i przecinają go w tym miejscu. Jeśli DNA dwóch bakterii różni się, enzymy potną go w różnych miejscach, ponieważ rozpoznawana przez nie sekwencja będzie zlokalizowana gdzie indziej (patrz rys.). Uzyskamy wtedy różnej wielkości kawałki DNA. Taką żelkę, zawierającą pocięty materiał genetyczny, umieszcza się z kolei w dużym kawałku żelu agarozowego, a ten w aparacie wypełnionym buforem, czyli cieczą utrzymującą stałe warunki reakcji zwanej elektroforezą. Jak sama nazwa wskazuje, reakcja związana jest z działaniem prądu. DNA, jako naładowane ujemnie, będzie wędrowało w żelu w kierunku elektrody dodatniej. Przeciskając się przez struktury żelu, poszczególne kawałki pociętego DNA będą się od siebie oddzielać, tworząc charakterystyczne dla szczepu wzory, porównywane potem komputerowo. Nie uwierzycie, ale analizując wzory DNA po elektroforezie znaleźliśmy zupełnie nowy biotyp!
Do Danii zawitała piękna wiosna. Był czerwiec, kiedy unosząc w ramionach raport z naszej mikrobiologicznej działalności jechałam do domu. Mogłam tam zostać, ale zdecydowałam się wrócić do Polski, ponieważ tu jest moje miejsce. I miejsce mojej nauki.
W badaniach wszystko może być naprawdę proste, wystarczy w to uwierzyć. Często słyszę opinie, że za granicą jest lepiej. W chwilach zwątpienia też zaczynam czasem tak myśleć. Ale przecież trawa jest zawsze bardziej zielona po drugiej stronie płotu. A w końcu to od nas zależy, jaką trawę posiejemy w swoim ogródku i jak będziemy o nią dbali.


Komentarze
Tylko artykuły z ostatnich 12 miesięcy mogą być komentowane.