Sojusznik raka zdemaskowany
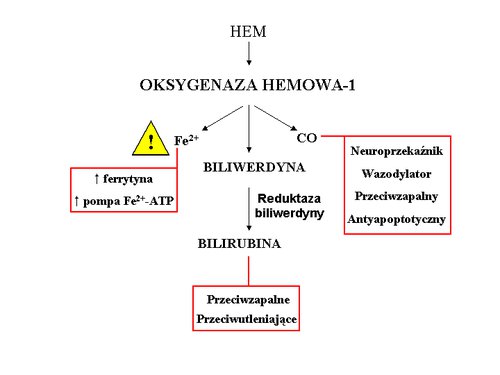
Rys. 1. Schemat działania oksygenazy hemowej−1 (HO−1)
HO−1 rozkłada hem do trzech produktów: tlenku węgla (CO), biliwerdyny oraz żelaza. Biliwerdyna jest następnie przekształcana w bilirubinę przez enzym cytozolowy – reduktazę biliwerdyny. Produkty rozpadu hemu mają własności przeciwzapalne, przeciwutleniające i antyapoptyczne.
Każdy miał chyba takie marzenie w dzieciństwie – zrobić coś ważnego dla ludzkości, zapisać się na kartach historii... Tematyka nowotworowa interesowała mnie od zawsze. Ale dopiero na studiach pojawiły się sprzyjające warunki, by zainteresowanie to przybrało namacalny kształt. Na czwartym roku studiów biologicznych trafiłam do Zakładu Biotechnologii Medycznej UJ, gdzie postanowiłam przygotować swoją pracę magisterską. Wachlarz proponowanych mi projektów był bardzo szeroki, jednak nie zawierał niczego, co bezpośrednio dotykałoby interesującej mnie problematyki. Moja determinacja była jednak na tyle duża, a pani promotor otwarta na nowe pomysły, że kilka dni później powstał szkic projektu, który stał się zaczątkiem przygody z nauką. Cel projektu i kręta droga do jego osiągnięcia wydawały mi się bardzo enigmatyczne, ale ponieważ ciekawości badawczej i zapału mi nie brakowało, postanowiłam podjąć wyzwanie.
Prawdziwe oblicze cząsteczki
W zakładzie właściwie wszystkie projekty, w większym lub mniejszym stopniu, dotyczyły jednej cząsteczki – oksygenazy hemowej−1 (HO−1). HO−1 jest to enzym obecny w większości tkanek zwierzęcych, a jego ekspresja wzrasta pod wpływem czynników stresowych, takich jak: promieniowanie UV, reaktywne formy tlenu (RFT), cytokiny prozapalne, metale ciężkie i wielu innych. HO−1 rozkłada hem do trzech produktów: tlenku węgla, biliwerdyny i żelaza (patrz: Rys. 1). Związki te pełnią wiele istotnych funkcji w organizmie, choć jeszcze do niedawna uznawano je za metaboliczne śmieci.
Tlenek węgla jest neuroprzekaźnikiem. Ponadto wpływa na funkcjonowanie układu krwionośnego. Powoduje rozkurcz mięśniówki naczyń i w efekcie zmniejsza ciśnienie krwi oraz hamuje zlepianie się płytek krwi, co z kolei zapobiega powstawaniu zakrzepów. Co więcej, reguluje stan zapalny. Wbrew pozorom, rozhulana reakcja układu odpornościowego w odpowiedzi na infekcję czy proces nowotworowy może przynieść więcej szkody niż pożytku. Dlatego działalność takich zaworów bezpieczeństwa, jak tlenek węgla, jest bardzo pożądana i gwarantuje organizmowi homeostazę.
Drugi produkt rozpadu hemu, biliwerdyna, także nie jest tak bezużyteczny, jak pierwotnie sądzono. To jedna z nielicznych substancji, z którymi zetknął się chyba każdy z nas. Kiedy? Po uderzeniu na skórze pojawia się siniak. To nic innego, jak znak, że w naczyniach krwionośnych z rozpadłych pod wpływem uderzenia czerwonych krwinek uwolnił się hem. Następnie w tym miejscu pojawia się HO−1, która rozkłada hem m.in. do biliwerdyny. Siniak zmienia kolor z sinego na zielony. A kiedy biliwerdyna, dzięki innemu enzymowi, zostaje przekształcona w bilirubinę, pozostaje nam tylko żółte wspomnienie po tym przykrym zdarzeniu.
Biliwerdyna nie jest jednak tylko substancją przejściową, jakby się mogło wydawać z tego opisu. Odkrycia ostatnich lat ukazują ją w zupełnie nowym świetle – to cząsteczka, która działa w organizmie jako bardzo wydajny przeciwutleniacz, tzn. substancja neutralizująca RFT. RFT (inaczej wolne rodniki tlenowe) nie kojarzą się nam z niczym dobrym. Ogólnie mówiąc, przyspieszają rozwój wielu chorób oraz starzenie się organizmu. A zatem już drugi produkt powstający w wyniku działalności HO−1 ma zdecydowanie pozytywne funkcje.
Ostatni produkt rozpadu hemu – żelazo, przez długi czas był zdecydowanie czarnym charakterem w opowieści o funkcjonowaniu organizmów. Pierwiastek ten bardzo mocno związany jest z wątkiem RFT, o którym wspomniałam wyżej. Jony żelaza pełnią funkcję katalizatora reakcji, w której powstaje najniebezpieczniejszy RFT – rodnik hydroksylowy. Reakcja, która bez udziału żelaza trwałaby wiele godzin, dzięki obecności jego jonów, zachodzi w ciągu sekund. Zatem nie bez przyczyny jonom tego metalu przez długi czas przypisywano negatywną rolę. Okazało się jednak, że nie ma tego złego, co by na dobre nie wyszło. Obecność żelaza uruchamia mechanizmy, dzięki którym pierwiastek ten usuwany jest z komórek i przestaje być dla nich toksyczny.
I tak produkty powstające w wyniku działalności HO−1 roztaczają szerokie spektrum funkcji niezwykle korzystnych z punku widzenia organizmu. „Ujawnienie” prawdziwego oblicza HO−1 i produktów powstałych z prowadzonej przez nią reakcji sprawiły, że wielu naukowców zdecydowało się zaprząc ją do terapii różnych chorób, np. układu krążenia czy podczas przeszczepiania narządów.
Rys. 2. Rola HO−1 w komórkach mysiego czerniaka
A: Komórki mysiego czerniaka linii B16 (F10) – widok komórek w mikroskopie kontrastowo−fazowym. B i C: Płuca myszy nastrzykniętych dożylnie komórkami czerniaka z widocznymi przerzutami. Komórki B16 (F10) z nadekspresją HO−1 (C) dają więcej przerzutów do płuc u myszy niż dzikie komórki B16 (F10) (B). D: HO−1 przyspiesza tempo rozwoju choroby nowotworowej na kilka sposobów: przyspiesza podziały komórek nowotworowych, chroni je przed stresem oksydacyjnym wywołanym np. przez odpowiedź układu odpornościowego lub terapię przeciwnowotworową, nasila angiogenezę, która umożliwia wzrost guzów pierwotnych i rozsiewanie się komórek nowotworowych po całym organizmie, hamuje odpowiedź układu odpornościowego; przyspiesza tempo pojawiania się guzów wtórnych.
Siły na zamiary
A co mają wspólnego HO−1 i nowotwory? Badania prowadzone w kilku ośrodkach na świecie przekonują, że mają, i to całkiem sporo. Ekspresja HO−1 jest zwiększona w wielu typach nowotworów i, co ważne, związane jest to z przyspieszonym wzrostem guzów pierwotnych oraz tworzeniem się przerzutów. Poza tym okazuje się, że tradycyjne terapie przeciwnowotworowe, takie jak: radio− czy chemioterapia, mogą włączać mechanizmy ochronne komórek nowotworowych, w tym zwiększać ekspresję HO−1. To oznacza paradoksalnie, że leczenie, zamiast pomóc, może zaszkodzić pacjentowi.
Z zagadnieniem tym wciąż jednak wiąże się wiele znaków zapytania, dlatego celem mojego projektu była próba udzielenia odpowiedzi przynajmniej na część z nich. Zakasałam rękawy i zabrałam się do pracy. Na początek należało wybrać model badawczy. Idealne wydały się nam komórki mysiego czerniaka linii B16 (F10). Podstawa teoretyczna? Czerniak to najpowszechniejszy nowotwór skóry. Natomiast z punktu widzenia czysto praktycznego, komórki tej linii stosunkowo łatwo bada się w warunkach in vitro oraz, co jest istotne w dalszej perspektywie, in vivo.
Plan pracy był następujący: sprawdzić, jaka jest rola HO−1 w komórkach czerniaka podczas hodowli in vitro, a jeśli wyniki okażą się obiecujące, zbadać, czy sytuacja ma się podobnie po wprowadzeniu tych komórek do organizmów zwierząt. Żeby przekonać się, jak HO−1 wpływa na komórki czerniaka, należało porównać dzikie komórki czerniaka z takimi, które miałyby HO−1 więcej. Komórki takie można uzyskać na kilka sposobów. Zdecydowaliśmy się na wyprowadzenie linii stabilnie stransfekowanej plazmidowym DNA zawierającym gen HO−1. Na czym to polega? Najpierw komórki poddaje się transfekcji, tzn. podaje się im plazmidowe DNA z interesującym nas genem, np. za pomocą specjalnego nośnika lipidowego. W moim przypadku plazmid zawierał gen HO−1 oraz dodatkowo gen oporności na antybiotyk. Obecność genu oporności na antybiotyk umożliwia wyselekcjonowanie komórek, które plazmid wbudowały. Jeśli komórki wbudowały plazmid, przetrwają hodowle w pożywce z antybiotykiem i po kilkutygodniowej selekcji nadekspresję pożądanego genu będzie można potwierdzić technikami molekularnymi.
Tarcza i broń
Przy odrobinie szczęścia i sporej dawce cierpliwości wyprowadziłam linię komórek mysiego czerniaka ze stałą nadekspresją HO−1 i przystąpiłam do właściwych badań. Po pierwsze sprawdziłam, czy nadekspresja HO−1 przyspiesza podziały komórek czerniaka. Okazało się, że tak. Komórki z nadekspresją HO−1 dzieliły się trzykrotnie szybciej niż ich dzikie odpowiedniki. Następnie zadałam sobie pytanie, czy takie komórki są bardziej odporne na stres oksydacyjny. Wiadomo, że układ odpornościowy próbuje poradzić sobie z toczącym się procesem nowotworowym i jako swoich żołnierzy wystawia m.in. RFT. Co więcej, zasada działania wielu terapii przeciwnowotworowych opiera się na generowaniu RFT. Żeby się przekonać, czy HO−1 stanowi tarczę ochronną dla komórek czerniaka przed bombardującymi je wolnymi rodnikami, potraktowałam obie linie – dziką i z nadekspresją HO−1 – niezbyt silnym oksydantem, wodą utlenioną (H2O2). I co się okazało? Komórki z nadekspresją HO−1 znacznie lepiej znosiły traktowanie H2O2 niż ich dzicy pobratymcy, co oznaczało, że HO−1 stanowi tarczę antyoksydacyjną dla komórek rakowych.
Na koniec chciałam sprawdzić, czy w układzie in vitro HO−1 zwiększa własności proangiogenne komórek czerniaka. Angiogeneza to proces, w którym powstają naczynia krwionośne z już istniejących. Średnica guza nowotworowego nie przekroczy 3 mm, jeśli nie jest on unaczyniony. Naczynia krwionośne nie tylko umożliwiają wzrost guzów nowotworowych, ale również stanowią jedną z głównych dróg rozsiewania się komórek nowotworowych po organizmie. Dlaczego w guzie zachodzi angiogeneza? Bo komórki nowotworowe produkują substancje proangiogenne, które stymulują wzrost naczyń krwionośnych w tkance guza. Żeby sprawdzić, czy HO−1 reguluje również produkcję czynników proangiogennych przez komórki nowotworowe, przeprowadziłam dwa testy z wykorzystaniem tzw. pożywek kondycjonowanych, czyli zebranych znad komórek jednego typu, którymi następnie traktuje się komórki innego typu. Zebrałam pożywki znad hodowanych 24 godziny komórek czerniaka – dzikich i z nadekspresją HO−1, a następnie potraktowałam nimi komórki śródbłonka. Stanowią one najbardziej wewnętrzną warstwę ściany naczynia krwionośnego i stosuje się je w badaniach nad angiogenezą in vitro. Okazało się, że pożywki znad komórek czerniaka z nadekspresją HO−1 silniej stymulują komórki śródbłonka do wzrostu i do tworzenia nowych naczyń krwionośnych. Zatem uzyskane wyniki wskazywały jasno, że HO−1 przyspiesza wzrost komórek czerniaka, chroni je przed stresem oksydacyjnym i zwiększa ich własności proangiogenne, czyli dodatkowo uzbraja je w cechy niebezpieczne w punktu widzenia gospodarza.
Pokonać nowotwór?
Wyniki uzyskane w warunkach in vitro często nie mają żadnego przełożenia na sytuacje w organizmie, dlatego do pełni szczęścia brakowało nam potwierdzenia naszych obserwacji w układzie in vivo. Badania na zwierzętach przeprowadziłam we współpracy z zaprzyjaźnionymi laboratoriami z Centrum Onkologii w Gliwicach i Akademii Medycznej w Warszawie. Rozpoczęliśmy od podania jednej grupie myszy podskórnie komórek czerniaka typu dzikiego, a drugiej – z nadekspresją HO−1 i sprawdziliśmy przeżywalność obu grup. Myszy, którym podano komórki z nadekspresją HO−1, ginęły znacznie szybciej niż myszy z dzikimi guzami. Następnie zmierzyliśmy wielkość guzów pierwotnych. Mimo że objętościowo guzy jednej i drugiej grupy nie różniły się od siebie, struktura ich była zupełnie inna. Zaobserwowaliśmy, że komórki czerniaka z nadekspresją HO−1 są ściślej upakowane w guzie, co potwierdzałoby, że HO−1 przyspiesza ich podziały. Ponadto stwierdziliśmy, że liczba naczyń krwionośnych w guzach z nadekspresją HO−1 jest dwukrotnie większa. Zwróciliśmy też uwagę na stan zapalny towarzyszący rozwojowi guzów. Guzy typu dzikiego naciekane były przez większą liczbę komórek zapalnych, a w surowicy myszy z takimi guzami wykryliśmy znacznie wyższe stężenie silnego czynnika prozapalnego – czynnika martwicy nowotworów (TNF). Surowica myszy nastrzykniętych czerniakiem z nadekspresją HO−1 właściwie nie zawierała TNF, a i liczba komórek zapalnych w tkance guza była niewielka. Oznaczało to, że zwiększona aktywność HO−1, hamując proces zapalny, który mógłby ewentualnie pomóc gospodarzowi zwalczyć intruza, wspomaga komórki czerniaka jeszcze w ten sposób. Na koniec sprawdziliśmy, czy HO−1 ma jakiś udział w tworzeniu przerzutów przez komórki czerniaka. Kiedy podaliśmy komórki obu linii do żyły ogonowej (jest to powszechnie stosowany model przy badaniu przerzutowania do płuc), zaobserwowaliśmy znacznie większą liczbę guzów wtórnych w płucach u myszy, które nastrzyknięto komórkami z nadekspresją HO−1. Wynik tego eksperymentu dopisał do i tak już długiej listy korzyści z posiadania nadekspresji HO−1 jeszcze jedną – zwiększenie zdolności komórek nowotworowych do rozsiewania się po tkankach gospodarza.
Jeden enzym, a tyle funkcji… Przyspiesza wzrost czerniaka i jego unaczynienie. Blokuje aktywność układu odpornościowego. Zwiększa szansę, że komórki nowotworowe dadzą przerzuty. W efekcie sprawia, że komórki nowotworowe zabijają szybciej…
Mogłoby się wydawać, że to koniec. A tak naprawdę to dopiero początek. Uzyskane odpowiedzi zrodziły nowe pytania. Najważniejsze z nich brzmi, czy wyłączenie HO−1 pozwoli pokonać nowotwór lub przynajmniej zwiększyć skuteczność dotychczas stosowanych terapii?
Mam nadzieję, że i na to pytanie uda mi się wkrótce odpowiedzieć.



Komentarze
Tylko artykuły z ostatnich 12 miesięcy mogą być komentowane.