To nie tak, jak myślisz
Nieznane oblicze rybosomu
Rybosomy, „fabryki białek”, to jedne z najważniejszych struktur znajdujących się w każdej żywej komórce. Niedobór lub nadmiar białek, a także błędy w ich budowie, mogą prowadzić do powstania wielu chorób, również nowotworów. Aby temu zapobiec, rybosomy w każdej komórce powinny być takie same i pracować tak samo. Dlaczego zatem tak nie jest? A może wcale nie powinny być takie same?
Te „nudne” rybosomy, czyli historia pewnej znajomości
Moja przygoda z rybosomami rozpoczęła się „na poważnie” podczas studiów, gdy w Zakładzie Biologii Molekularnej UMCS wykonywałem badania do pracy magisterskiej. Nie wiedziałem wtedy jeszcze, że zakład ten można śmiało nazywać Zakładem Rybosomologii Uwielbionej (albo coś w tym stylu). Szybko się jednak zorientowałem, że bez dobrej znajomości rybosomów nie mam tam za bardzo czego szukać. Zabrałem się do pracy i przyznaję otwarcie, że nie dopadło mnie nagłe zauroczenie rybosomami, lecz początkowo była to raczej znajomość z konieczności. Początkowo, bo najlepsze miało dopiero nadejść.
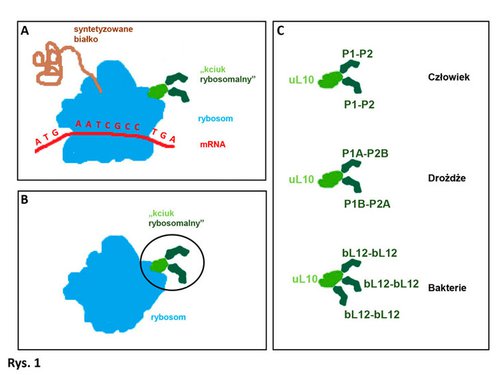
Ale od początku. Rybosomy to struktury, które znajdują się w każdej żywej komórce. Są swego rodzaju fabrykami/maszynami, które rozszyfrowując odpowiednie „instrukcje” (zapisane w cząsteczce mRNA), biernie i automatycznie (jak mi się wtedy wydawało) „tłumaczą je”, produkując białka (Rys 1A). A białka są kluczowe dla komórki, ponieważ pełnią w niej zarówno funkcję budulcową, jako element struktur komórkowych, jak i enzymatyczną, odpowiadając za oddychanie, odżywianie czy poruszanie się komórki. Jak zbudowany jest rybosom? Nie szukając skomplikowanego przykładu: tak jak cegielnia produkująca cegły zbudowana jest z cegieł, tak rybosom produkujący białka zbudowany jest z białek, zwanych białkami rybosomalnymi (i jeszcze innego elementu, rybosomalnego RNA (rRNA), który można porównać do instalacji elektrycznej cegielni). Rybosomy bakteryjne różnią się budową od rybosomów ludzkich, ale już wszystkie rybosomy w każdej komórce człowieka powinny być takie same. Dlaczego? Zaburzenie „równowagi białkowej” w komórce (nadmiar lub niedobór białek) powoduje liczne choroby, jak np. nowotwory, dlatego też w każdej komórce rybosomy powinny produkować odpowiednią ilość poprawnie zbudowanych białek. Aby tak było, rybosomy powinny pracować tak samo, a więc powinny być takie same. Można pomyśleć (tak jak ja myślałem w tamtym czasie), że rybosomy to maszyny o niezmiennej kompozycji, pełniące istotną, ale rutynową i mało ekscytująca funkcję w komórce. Nie jest to prawdą.
Rybosomalne centrum GTPazowe – „silnik” rybosomu
Moja przelotna znajomość z rybosomami stopniowo przekształcała się w zauroczenie. Podczas prowadzenia badań w ramach pracy doktorskiej zacząłem dostrzegać w rybosomie coś więcej niż tylko „bezrefleksyjną maszynę molekularną”, tak jak koleżanka ze szkolnej ławy w miarę upływu czasu staje się coraz bardziej interesująca. Między innymi dlatego, że praca doktorska dotyczyła rybosomalnego centrum GTPazowego (GAC, ang. GTPase Associated Center ), kluczowego elementu rybosomu, który jak silnik w samochodzie dostarcza energii niezbędnej do jego funkcjonowania. Patrząc na strukturę rybosomu łatwo zauważymy rejon GAC, ponieważ stanowi go kompleks białek wyeksponowanych na zewnątrz, zwany „kciukiem rybosomalnym” (Rys 1B). Kompleks ten nazywamy kciukiem, bo – tu nie będzie niespodzianki – przypomina wystający kciuk dłoni z zaciśniętymi pozostałymi palcami. Na czym polega jego rola? „Kciuk rybosomalny” „wyłapuje” specjalne białka zasocjowane z cząsteczkami magazynującymi energię (GTP) i przybliża je do tzw. pętli sarcynowo-rycynowej rybosomu. Tam następnie energia chemiczna zmagazynowana w cząsteczce GTP zostaje uwolniona i przekształcona w energię mechaniczną, niezbędną do funkcjonowania rybosomu.
Przejdźmy teraz do struktury „kciuka”. Jest on zbudowany z białka uL10, występującego u wszystkich organizmów i „kotwiczącego” cały „kciuk” do rybosomu, oraz związanych z nim białek bL12 (występujących u bakterii) lub P1/P2 (występujących u pozostałych organizmów, takich jak drożdże czy ssaki). Warto zaznaczyć, że białka rybosomalne występują na rybosomie pojedynczo, czyli np. rybosom zawiera tylko jedno biało uL11. Analizując budowę „kciuka rybosomalnego” u różnych organizmów zauważymy, że bakterie mają cztery (bakterie mezofilne), sześć (termofilne) lub osiem (cyjanobakterie) białek bL12. Drożdże z kolei mają cztery różne białka: P1A, P1B, P2A, P2B, które formują dwie pary P1A-P2B i P1B-P2A. Natomiast „kciuk rybosomalny” ssaków zawiera dwie pary białek P1-P2 (Rys 1C). Intrygujące, prawda?
Modyfikacje „silnika” rybosomu
Dlaczego rybosomy pewnych bakterii posiadają cztery, a inne sześć kopii tego samego białka bL12? Może ma to związek ze środowiskiem, w którym żyją bakterie? Sześć kopii białka bL12 mają rybosomy bakterii żyjących w bardzo wysokiej temperaturze. Czyżby w wyższej temperaturze „silnik rybosomu” musiał pracować szybciej? Dlaczego rybosomy drożdżowe mają cztery różne białka P1A, P1B, P2A i P2B? Może każde z tych białek pełni nieco inną funkcję? Czy poprzez modyfikacje w kompozycji białek „kciuka rybosomalnego” można zmieniać funkcjonowanie rybosomu? Okazuje się, że tak.
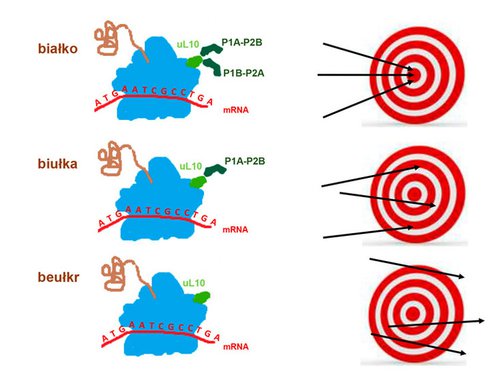
Badania przeprowadzone na komórkach drożdżowych wykazały, że rybosomy pozbawione jednej pary białek P1A-P2B popełniają więcej „błędów” w produkcji białek w porównaniu z rybosomami niezmodyfikowanymi. Jeszcze większy efekt „mylenia się” rybosomu zaobserwowano wtedy, gdy rybosomy pozbawiono obu par białek P1A-P2B i P1B-P2A (Rys 2). Zatem wielokopijność białek „kciuka rybosomalnego” powiązana jest z precyzją funkcjonowania rybosomu. Czy rybosom zawsze powinien być dokładny i produkować „poprawne” białka? Może, żeby przetrwać w niekorzystnym środowisku, komórka drożdżowa modyfikuje rybosomy w taki sposób, by obniżyć ich precyzję? Może produkcja „błędnych białek” okaże się zbawienna i „błędne białko” pozwoli jej się przystosować? Czy to oznacza, że komórka, aby szybko dostosować się do zmiennych (przeważnie niekorzystnych) warunków środowiskowych, modyfikuje rybosomy poprzez modyfikację ich „kciuka rybosomalnego”? W ten sposób bezpośrednio zmieniałaby się jakość produkowanych białek. A w sytuacji, gdy komórka musi szybko zaadaptować się do niekorzystnych warunków zewnętrznych, najlepszym rozwiązaniem jest zmiana obecnego w niej „profilu białek”. Oznaczałoby to, że rybosom nie jest już tylko biernym producentem białek, lecz aktywnym regulatorem metabolizmu, którego rola zmienia się w zależności od stanu komórki i środowiska zewnętrznego.
A to wcale nie koniec pytań. Jeśli bowiem ilość białek formujących „kciuk rybosomalny” może podlegać zmianom, to co się dzieje z tymi białkami „kciuka”, które w danym momencie nie są zasocjowane z rybosomem? Czy białka te pełnią jakieś funkcje niezwiązane z rybosomem? Robi się coraz ciekawiej.
Praca na wielu etatach
Większość białek rybosomalnych występuje w komórce w formie związanej z rybosomami, stanowiąc element jego struktury i biorąc udział w procesie produkcji białek. Natomiast niektóre z nich biorą udział również w procesach innych niż produkcja białek. Przykładem jest białko „kciuka rybosomalnego” uL10 uważane za „wielofunkcyjne”, które powiązano z wieloma stanami patologicznymi, takimi jak nowotwory, toczeń rumieniowaty układowy, depresja czy choroba Alzheimera. I właśnie zbadanie „pozarybosomalnych” funkcji białka uL10 było głównym celem mojej pracy doktorskiej. Założyłem, że jeśli uL10 pełni jakieś „pozarybosomalne” funkcje, to musi być odseparowane od rybosomu. Skoro tak, to musi się w jakiś sposób „odłączyć” od rybosomu. Postanowiłem odkryć, kiedy – i czy w ogóle – takie zjawisko ma miejsce.
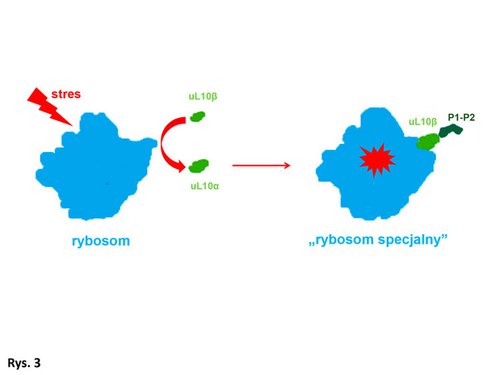
Istnieje teoria, wedle której to, jakimi ludźmi jesteśmy naprawdę, ujawnia się dopiero w sytuacjach ekstremalnych (takich jak np. pożar czy porwanie). Mając tę myśl w głowie, komórki ssacze poddałem działaniu różnych czynników stresowych. Okazało się, że w warunkach stresowych białko uL10 uwalnia się z pewnej puli rybosomów i utrzymuje się w komórce, co świadczy o tym, że jest potrzebne. Zatem rybosomy, które występują w komórkach „zestresowanych” („rybosomy stresowe”), są inne od rybosomów znajdujących się w komórkach „niezestresowanych”. Jest to dowód, że komórka przystosowuje się do warunków stresowych poprzez modyfikację rybosomów, polegającą na modyfikacji „kciuka rybosomalnego” i inaktywowaniu pewnej ich ilości (rybosomy pozbawione białka uL10 są niefunkcjonalne). Białko uL10 pełni więc rolę „sensora stresu” i po odłączeniu się od rybosomu zyskuje „nowe życie”, prawdopodobnie w celu pełnienia innej funkcji w komórce.
Co się dzieje z rybosomami pozbawionymi białka uL10? Może na miejsce uL10 „wskakuje” inne białko, przywracając te rybosomy „do życia”? A jeśli tak, to jakie jest „nowe życie” rybosomu?
Nieoczekiwana zmiana miejsc
Analizując bazy danych, zauważyłem, że białko uL10 istnieje w dwóch formach: podstawowej, która buduje „kciuk rybosomalny”, i alternatywnej, o nieznanej funkcji w komórce. Alternatywna forma białka uL10 (nazwana przeze mnie uL10ß) różni się od formy podstawowej (uL10?) brakiem kilkudziesięciu aminokwasów w środkowej części tego białka. Co ciekawe, ta część białka uL10?, która jest odpowiedzialna za wiązanie się do rybosomu, jest taka sama w białku uL10ß. Sugeruje to, że uL10ß może asocjować z rybosomem w tym samym miejscu co uL10?. Przeprowadzone przeze mnie doświadczenia pokazują, że właśnie tak jest: białko uL10ß wiąże się do rybosomów ludzkich. Ponieważ fragment białka uL10?, którego brak u uL10ß, odpowiada za wiązanie jednej pary białek P1-P2, oznacza to, że uL10ß może wiązać teoretycznie tylko jedną parę białek P1-P2.
Wydaje mi się, że wiem, o czym Państwo teraz myślą. Kiedy mianowicie – i w jakich okolicznościach – ma miejsce przyłączenie się białka uL10ß do rybosomu i w jaki sposób taka konfiguracja „kciuka rybosomalnego”, zbudowanego z białka uL10ß i jednej pary białek P1-P2, wpływa na funkcjonowanie rybosomu? Jak zmienia się rybosom mający tak zmodyfikowany „silnik”? Być może białko uL10? uwalnia się z rybosomu, by pełnić funkcję w innych procesach komórkowych, a na jego miejsce do rybosomu przyłącza się uL10ß, formując zupełnie inny „kciuk rybosomalny” (Rys. 3)? Czy w ten sposób może powstać nowa klasa rybosomów, która różniłaby się od innych budową i funkcją?
Rybosomy specjalne czy specjalnej troski?
Rybosom przez długi czas był uważany za statyczną, wielokomponentową strukturę, która pełni pasywną rolę w syntezie białek i pozbawiona jest aspektów regulatorowych. Na przestrzeni lat obraz ten uległ zmianie i obecnie panuje przekonanie, że rybosomy wykazują zróżnicowanie strukturalne, które przekłada się na ich funkcjonalną specjalizację. Krótko mówiąc, teraz uważamy, że pewne rybosomy mogą się „wyspecjalizować”. Rybosomy specjalne/wyspecjalizowane (ang. specialized ribosomes ) mogą powstać na skutek modyfikacji białek rybosomalnych, braku pewnych białek rybosomalnych lub też pojawienia się alternatywnych form białek rybosomalnych oraz modyfikacji rRNA. Jaka jest rola rybosomów specjalnych? Zachowują się one jak „molekularny filtr”, który w zależności od kompozycji może „selekcjonować” dostępne „instrukcje” zawarte w cząsteczkach mRNA i tym samym produkować wybrane białka w komórce. Ma to szczególne znaczenie w przypadku pojawienia się niekorzystnych warunków środowiskowych, kiedy komórka ma niewiele czasu na przystosowanie się i najlepszym rozwiązaniem jest zmiana „garnituru białkowego”. Przykładem potwierdzającym istnienie rybosomów specjalnych są rybosomy znajdujące się w jądrach u mężczyzn, zawierające zmodyfikowaną wersję białka eS4. Teraz rozumiemy, że są to organy szczególne, skoro muszą zawierać specjalne, „jądrowo specyficzne” rybosomy.
Ale czy zawsze obecność w komórce rybosomów o zmienionej strukturze jest dla komórki korzystna? Otóż często mutacje w białkach rybosomalnych powodują różne tkankowo specyficzne defekty – rybosomopatie, które powiązane są ze zwiększonym ryzykiem zachorowania na nowotwory. Przykładem jest niedokrwistość Diamonda-Blackfana (ang. Diamond-Blackfan anemia ), związana z mutacjami w 15 białkach rybosomalnych, czy zespół delecji chromosomu 5q (ang. 5q syndrome ) związany z mutacją w białku uS11. Takie rybosomy należy raczej nazwać rybosomami specjalnej troski lub patologicznymi, często upośledzonymi na tyle, by powodować choroby nowotworowe.
To dobrze czy źle?
Istnienie rybosomów o odmiennej budowie jest kolejnym elementem potwierdzającym złożoność mechanizmów regulujących funkcjonowanie komórki. Z jednej strony modyfikacje rybosomów np. pozwalają przetrwać komórkom, które akurat znalazły się w „trudnej sytuacji”. Uwolnienie białka uL10? z pewnej puli rybosomów w komórkach „zestresowanych” inaktywuje tę cześć rybosomów, ale pozwala tym komórkom przystosować się i przeżyć. Z drugiej strony zdarza się również, że upośledzone rybosomy prowadzą do powstania licznych chorób. Dlatego w różnych komórkach (a nawet w jednej komórce) rybosomy nie zawsze są takie same. Zmiany w strukturze dające im „nowe właściwości” nie mogą dotyczyć wszystkich rybosomów w komórce (lub wszystkich komórek organizmu), tak jak znajomość języka chińskiego może czynić nas wyjątkowymi, do momentu aż reszta nie nauczy się tego języka. Uwolnienie białka uL10? ze wszystkich rybosomów w komórce całkowicie zahamowałoby produkcję białek, a tym samym spowodowałoby śmierć komórki. Dobrze, że rybosomy nie są jednakowe, bo może właśnie ich różnorodność sprawiła, że w ewolucji zaszliśmy tak daleko.
Proszę wybaczyć, ale na koniec małe wyznanie. Cieszę się, że jestem częścią tak pasjonującego projektu i mam już swój niewielki wkład. Na pewno na tym nie poprzestanę. Teraz chyba muszę przyznać, że znajomość z konieczności przerodziła się w prawdziwą miłość.


Dodaj komentarz
Komentarze