Inteligentni posłańcy
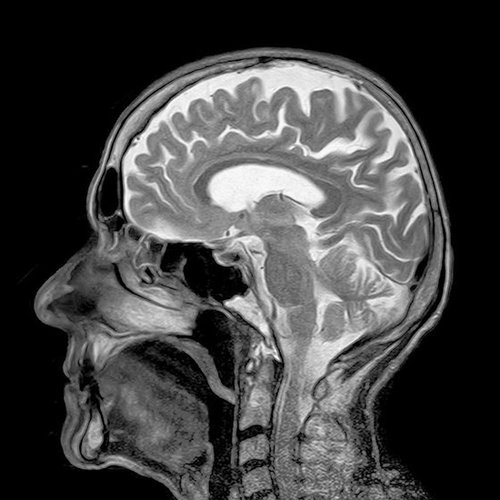
Współczesne techniki bezinwazyjnego obrazowania, do których należą m.in. pozytonowa tomografia emisyjna (PET), obrazowanie magnetyczno-rezonansowe (MRI, zwane często potocznie „rezonansem”), tomografia komputerowa (CT), umożliwiają trójwymiarowe badanie fragmentów ciała czy poszczególnych organów z dużą dokładnością. Opierają się one na różnych zjawiskach fizycznych. CT wykorzystuje różnicę pochłaniania promieniowania rentgenowskiego wśród pierwiastków zawartych w poszczególnych tkankach i ośrodkach. PET wymaga podania izotopów, które emitują pozyton – dodatnio naładowany elektron, który na skutek spotkania z klasycznym elektronem znika, anihiluje, emitując charakterystyczną parę fotonów. Źródłem pozytonów są najczęściej nuklidy 18F połączone z glukozą. Zmiana metabolizmu glukozy w wyniku określonych zmian chorobowych jest ważnym markerem diagnostycznym w tej technice. Natomiast MRI wymaga umieszczenia badanego pacjenta w bezpiecznym, ale silnym polu magnetycznym. Wtedy pewne atomy mogą ulegać wzbudzeniu, a ich powrót do podstawowego stanu energetycznego, zwany relaksacją, jest przedmiotem analizy skanera MRI i przekłada się na obraz anatomiczny. Szczęśliwie się składa, że w ten sposób zachowuje się wszechobecny wodór, a dokładniej jego dominujący nuklid – prot 1H, który wchodzi w skład wody i wielu związków organicznych w organizmie i to właśnie na tym nuklidzie skupione są elementy odbiorcze skanera.
Klasyczne środki kontrastowe
Środki kontrastowe stosuje się w około połowie wszystkich badań diagnostycznych z wykorzystaniem obrazowania magnetyczno-rezonansowego. Będące powszechnie w użyciu środki kontrastowe do rezonansu magnetycznego, to głównie związki kompleksowe gadolinu. Pierwiastek ten, należący do lantanowców, ma aż siedem niesparowanych elektronów, które sprawiają, że jego związki są silnymi paramagnetykami. Te maleńkie, molekularne magnesy oddziałują z cząsteczkami wody i umożliwiają atomom wodoru znacznie szybszy powrót do stanu podstawowego w badaniu MRI. W ten sposób, przy odpowiednim doborze parametrów pomiaru, cząsteczki wody, w których sąsiedztwie znalazł się środek kontrastowy, są obserwowane jako jaśniejsze pole na obrazie MRI. Gdyby wprowadzone do organizmu związki gadolinu rozlokowały się w nim równomiernie, efekt kontrastu nie miałby wielkiej wartości diagnostycznej, gdyż wtedy wszystkie obrazy byłyby po prostu jaśniejsze. Natomiast dzięki temu, że środki te mają większe powinowactwo do komórek o przyspieszonym metabolizmie, a tak właśnie zachowują się komórki nowotworowe, jest szansa na lokalizowanie guzów dzięki ich zwiększonemu kontrastowi.
Stosowane dotąd farmaceutyki uznawane były za stosunkowo bezpieczne, jednak w czasie ich 30-letniej historii pojawiły się różne doniesienia, które coraz bardziej skłaniają do poszukiwań nowych modeli. Największy niepokój budziły nieliczne na szczęście przypadki skutków ubocznych obserwowane szczególnie u pacjentów z dysfunkcją nerek. Niestety wielokrotne stosowanie może wywołać objawy chorobowe zwane nerkopochodnym włóknieniem układowym. U większości pacjentów w ciągu 2 godzin połowa wprowadzonego środka opuszcza organizm przede wszystkim z moczem, a w ciągu następnych 10 godzin 90% środka jest już wydalone. Ale w nielicznych przypadkach obserwuje się niewielką akumulację związków gadolinu w organizmie. Dodatkowo ekolodzy dyskutują o wpływie na środowisko zwiększonego stężenia gadolinu w ściekach klinicznych. Nie bez znaczenia jest też małe rozpowszechnienie gadolinu na świecie, co spowodowało uznanie go przez Komisję Europejską w 2014 za jeden z krytycznych surowców dla gospodarki Unii Europejskiej.
Nowe związki kontrastowe, które sukcesywnie zastępują pierwsze kompleksy gadolinu, są przede wszystkim coraz bezpieczniejsze, czyli ilość ewentualnych działań ubocznych jest coraz mniejsza. Ponadto nowe modele są bardziej efektywne, co oznacza, że nawet przy mniejszej dawce prowadzą do pojawienia się lepszego kontrastu na obrazach wykonanych przy użyciu rezonansu magnetycznego. Wreszcie trzecia cecha następców pierwszych związków gadolinu, to ich zwiększona selektywność do poszczególnych typów komórek i tkanek. Dzięki temu uzyskuje się jeszcze lepszy efekt diagnostyczny.
Nasza grupa podjęła także wyzwanie polegające na zastąpieniu egzogennego, obcego organizmowi gadolinu naturalnym mikroelementem – żelazem. Otrzymaliśmy szereg nowych związków kompleksowych żelaza, które dorównują stosowanym obecnie preparatom gadolinowym pod względem przewidywanego efektu kontrastowego, a zarazem eliminują ich wady związane z ceną, dostępnością gadolinu oraz z jego znanymi efektami ubocznymi. Ponadto w Politechnice Śląskiej w grupie dr. hab. Tomasza Krawczyka prowadzone są badania nad środkami kontrastowymi, które miałyby zastosowanie w bliźniaczej technice – 19F MRI, która analizuje związki fluorowe w organizmie. Nasze badania są realizowane we współpracy z Uniwersytetem w Osace (Japonia), gdzie zespół prof. K. Kikuchiego przeprowadził wstępne analizy obrazów myszy z wykorzystaniem naszych środków kontrastowych. Przychylnym okiem patrzą na nasze badania naukowcy z Instytutu Onkologii w Gliwicach. Prof. Maria Sokół wraz ze swoim zespołem od lat zajmuje się badaniami metabolitów w mózgu oraz modelowaniem płynów naśladujących płyn mózgowo-rdzeniowy i chętnie sięga po technikę MRI ze środkami kontrastowymi, być może kiedyś i tymi otrzymanymi w naszych laboratoriach. Istnieje też zainteresowanie firm farmaceutycznych, głównie tych specjalizujących się w środkach kontrastowych. We wstępnych rozmowach nakreśliliśmy kryteria, jakie muszą spełnić związki aktywne, aby mogły wejść w fazę testów. Obecnie pracujemy nad modyfikacjami w strukturach tych związków tak, aby te oczekiwania spełnić.
Superkontrast
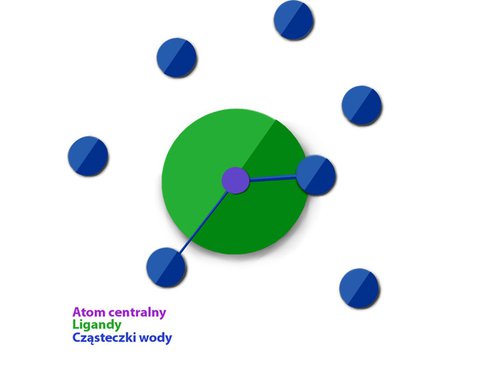
W badaniach nad nowymi środkami kontrastowymi można zauważyć pewną formę wyścigu bicia kolejnych rekordów. Wśród nich efektywność, z jaką pojedyncze cząsteczki poprawiają kontrast obrazu zwaną relaksacyjnością, wybija się na czołowe kryterium. Poznanie mechanizmu działania środków kontrastowych na poziomie molekularnym umożliwiło projektowanie takich cząsteczek (Rys. 2). Rozpoznano kilka czynników, które decydują o finalnym efekcie kontrastu. Jest to m.in. wielkość cząsteczki, która wpływa na jej ruch w wodnym środowisku płynów ustrojowych. Dodatkowo istotne jest, aby jej fragmenty mogły oddziaływać z innymi składnikami ośrodka. Jednym z dominujących składników krwi są białka zwane albuminami, dlatego też nowe cząsteczki środków kontrastowych, których celem jest badanie układu krwionośnego, mają grupy o dużym powinowactwie do białek albuminowych. Z drugiej strony ważne jest także, aby cząsteczki wody, które są wprost analizowane przez skaner tomografu, mogły w jak największej ilości spotkać się z cząsteczką kontrastu. Te i inne cechy nowych modeli umożliwiły otrzymanie związków, których relaksacyjności są nawet 10-krotnie wyższe od stosowanych obecnie preparatów. Podanie takich kontrastów pacjentowi pozwalałoby na znaczne obniżenie stosowanej dawki, co w rezultacie praktycznie eliminowałoby ewentualne skutki uboczne.
Inną klasyfikacją rekordów jest polimodalność. Pacjenci, szczególnie ci o bardziej złożonych jednostkach chorobowych lub tacy, u których chorobom nowotworowym towarzyszą na przykład dysfunkcja nerek czy cukrzyca, przechodzą szereg badań diagnostycznych. Po tomografii komputerowej są poddawani badaniom przy pomocy obrazowania magnetyczno-rezonansowego lub PET. Pomimo że techniki te mają różne podstawy fizyczne, można tak zaprojektować model środka kontrastowego, aby powodował polepszenie obrazu diagnostycznego w każdej z nich. Realizuje się to przez wbudowanie w strukturę środka kontrastowego cech, na które dana technika jest wrażliwa. Wiadomo, że środek kontrastowy do CT powinien zawierać ciężkie atomy, silnie absorbujące promieniowanie rentgenowskie. W tej roli doskonale sprawdza się jod. Obrazy MRI będą miały lepszy kontrast, jeśli poda się substancje paramagnetyczne, co klasycznie zapewnia gadolin. Badania PET wykorzystują za to metabolizm związków z izotopem fluoru-18. Można więc wszystkie te elementy połączyć w jedną cząsteczkę i w ten sposób podać pacjentowi trójmodalny środek kontrastowy. W badaniach biologicznych zwierząt wykorzystuje się jeszcze inne techniki obrazowania oparte na fluorescencji czy analizie zachowania się ultradźwięków. Dlatego też obecnie rekord polimodalności uzyskał heksamodalny środek kontrastowy użyteczny aż w sześciu technikach obrazowania jednocześnie.
Inteligentni posłańcy
Ponad dziesięć lat temu zaczęto snuć wizje, że po środku kontrastowym można oczekiwać czegoś więcej niż tylko wzmocnienia sygnału w obszarze, w którym już nastąpiły wizualne efekty zmiany chorobowej. Jeśli model cząsteczki chemicznej mógłby zmieniać swoje właściwości pod wpływem bodźców specyficznych dla niepokojących zmian w komórkach czy fragmentach tkanek, to można by diagnozować rozwój choroby na dużo wcześniejszych stadiach. Stwierdzono, że komórki bardzo wcześnie „informują” o stanie patologicznym, jednak zasięg tych informacji i słabość tego sygnału nie pozwalają na szybką diagnozę klasycznymi, powszechnymi metodami, np. poprzez badanie próbki krwi. W ten sposób zrodziła się nowa generacja, tak zwanych inteligentnych środków kontrastowych (ang. smart contrast agents ). W ostatnim czasie unika się jednak określenia smart (inteligentny) w tym kontekście, ze zrozumiałych względów – braku inteligencji w relatywnie prostej cząsteczce chemicznej (jak i większej powściągliwości po ostygnięciu pierwszego entuzjazmu w tej dziedzinie). Mówi się raczej o bioaktywowalnych środkach kontrastowych.
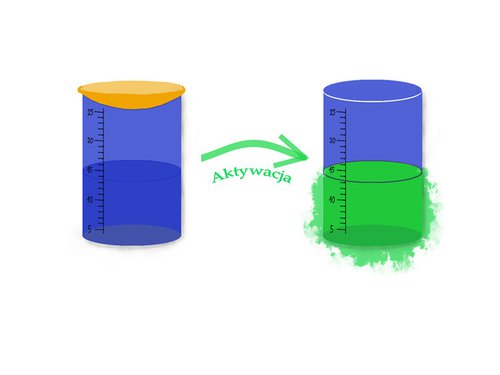
Stworzono już szeroką bibliotekę modeli związków, które zmieniają swoje zachowanie na skutek różnych czynników fizjologicznych. I tak zmiana stężenia jonów wodorowych, konkretnie obniżenie pH, jest charakterystyczne dla komórek nowotworowych. Komórki te wykazują także przyspieszony metabolizm, a co za tym idzie szybciej konsumują tlen i mają większe zapotrzebowanie na makro– i mikroelementy. Dlatego też nowe, bioaktywowalne środki wprowadzane są do organizmu w postaci uśpionej, nieaktywnej, niepowodującej zwiększenia kontrastu na obrazie. Gdy jednak pojawi się marker, na którego obecność zostały zaprojektowane, związki te zmieniają swój charakter, powodując zwiększenie kontrastu w miejscu, w którym się on uaktywnił. W ten sposób można z dużą dokładnością zlokalizować źródło i rodzaj ważnych sygnałów diagnostycznych.
Idea i eksperymenty na izolowanych komórkach czy nawet na zwierzętach są już bardzo spektakularne. Ale pojawia się szereg problemów, które muszą być jeszcze pokonane, aby środki te mogły przejść przez fazy testów klinicznych i zostać dopuszczone do powszechnego stosowania. Nasz zespół zaprojektował i otrzymał także cząsteczki (znowu zawierające paramagnetyczne żelazo), które są aktywowane działaniem enzymów. W ten sposób można stwierdzić, czy dany enzym jest obecny w docelowym miejscu oraz jak szybko go przybywa. Zwiększone ilości enzymów są również istotnymi markerami w zmianach chorobowych, ponadto są wykorzystywane w inżynierii genetycznej.
Nie tylko diagnoza
Opisane dotąd pomysły mają wspomagać przede wszystkim diagnostykę, czyli odpowiedzi na pytania, czy i ewentualnie gdzie pojawia się jakiś niepokojący element zmiany chorobowej. Jest to podstawą do decyzji o podjęciu leczenia. Są jednak już pomysły, aby połączyć diagnozę z terapią, a substancje, które mogą być w tym celu wykorzystane, określa się jako teranostyki (od połączenia słów terapia i diagnostyka). Można sobie wyobrazić, że jest pewna makrocząsteczka, która niesie ze sobą lek, np. powoli uwalniany, aby zwalczać stan chorobowy, oraz element kontrastowy, który jednocześnie umożliwia satysfakcjonujące śledzenie terapii. Zadania, które musi spełnić taka cząsteczka, są trudne i często przeciwstawne, dlatego też wyzwanie stworzenia teranostyków jest bardzo ambitne. Z jednej strony oczekiwalibyśmy, aby taka molekuła trafiła w miejsce zmienione chorobowo i pozostała w pobliżu przynajmniej przez pewien czas, uwalniając substancję terapeutyczną, a z drugiej strony nie byłoby dobrze, gdyby rozkładała się w tym czasie, uwalniając obcy organizmowi gadolin, który został w tej molekule wprowadzony w celu poprawy diagnostycznego kontrastu. Tym niemniej naukowcy podejmują takie wyzwania, mając świadomość ich złożoności.
Terapia fotodynamiczna (PDT) wykorzystuje wysoką energię światła laserowego i umożliwia często bezinwazyjne leczenie. Odbywa się to pośrednio przez aktywowanie podanego fotouczulacza – cząsteczki, która pod wpływem promienia światła o wysokiej energii uaktywnia się i staje się toksyczna dla lokalnych komórek, np. nowotworowych czy obcych mikroorganizmów. Gdyby się udało połączyć cząsteczkę fotouczulacza ze środkiem kontrastowym, byłaby możliwa bieżąca analiza przebiegu terapii. Badacze również na tym polu zaproponowali już kilka obiecujących modeli. W tym kierunku zmierzają także nasze badania, które realizujemy we współpracy z prof. Sławomirem Bonclem z naszej alma mater, wykorzystując zmodyfikowane nanorurki węglowe. Takie nanocząstki mogą służyć jako fotouczulacze, skupiając promieniowanie laserowe, a zarazem przyczyniając się do wizualnego efektu w obrazowaniu magnetyczno-rezonansowym. Nasi partnerzy z Japonii potwierdzili obiecujące efekty tych nanocząstek w badaniach na zwierzętach.
Co dalej?
Zrozumienie działania środków kontrastowych oraz rozwój diagnostycznych technik obrazowania pozwoliły na stworzenie nowych, niezwykłych modeli, które mają szansę doprowadzić do przełomu w identyfikacji wielu chorób. Już teraz w niektórych najbardziej postępowych krajach diagnostyka obrazowa stała się najważniejszym elementem medycyny. Z pewnością bardzo pomocne w tym będą nowe, bioaktywowalne środki kontrastowe. Przypuszczalnie przyjmą one formę sond molekularnych, czyli ściśle zaprojektowanych cząstek dających jednoznaczne sygnały na bardzo wczesnym etapie rozwoju choroby.
Nauka chciałby posunąć się nawet dalej. Sama, nawet znakomita, wczesna diagnostyka nie wystarczy, aby uniknąć leczenia np. urazów, a leczenie chorób rzadkich i autoimmunologicznych może być nadal bardzo trudne. Dlatego też elementy diagnostyczne łączone są z terapią.
Możemy więc mieć nadzieję, że rozwój nowych środków kontrastowych pozwoli nam pozostać dłużej w dobrym zdrowiu i móc z pasją obserwować dalsze zmagania badaczy na skrzyżowaniu medycyny, biologii, fizyki i chemii.


Komentarze
Tylko artykuły z ostatnich 12 miesięcy mogą być komentowane.