SpongeGrafen podbija nanoświat
Wcale nie tak „dawno, dawno temu”, bo w 2004 roku, świat obiegła wieść o dwóch naukowcach – Andrieju Gejmie i Konstantinie Nowosiołowie – którym udało się otrzymać oraz zbadać grafen. To wydarzenie spowodowało przełom we współczesnej nauce i wywołało wzmożenie prac nad tym materiałem przez wiele grup badawczych na całym świecie. Cóż to takiego ten grafen i dlaczego tak nagle przykuł uwagę naukowców?
Może nie każdy czytelnik zdaje sobie sprawę z faktu, iż grafit – ten, który bardzo dobrze znamy z wnętrza ołówka – składa się z wielu cienkich warstw atomów węgla. Atomy te ułożone są obok siebie w taki sposób, że tworzą sześciokątne pierścienie przypominające wzór plastra miodu. Grafen to właśnie pojedyncza płaszczyzna grafitu o grubości jednego atomu. A więc jeśli grafit porównalibyśmy do ryzy papieru do drukarki, grafen byłby wtedy pojedynczą kartką. Cieniutki i niepozorny, lecz – jak się okazuje – ma niesamowite właściwości. Świetnie przewodzi prąd elektryczny: elektrony w grafenie poruszają się z zawrotną prędkością, a więc materiał ma niski opór elektryczny. Ponadto jest niezwykle wytrzymały mechanicznie – rozpięta płaszczyzna grafenu nie uległaby przebiciu, nawet gdyby postawić na niej słonia stojącego na igle. Cechuje go także duża elastyczność i rozciągliwość. Mało tego, tak cienka warstwa atomów węgla jest przezroczysta (pochłania tyko niewielki procent światła białego).
Jak można więc otrzymać pojedynczy arkusz grafenu? Panowie Gejm i Nowosiołow użyli do tego taśmy samoprzylepnej. Przyklejali ją do bloczka grafitu i to, co się na niej osadziło, obserwowali pod mikroskopem. Aby uzyskać jak najcieńsze płatki, do taśmy doklejali kolejną taśmę, aż do skutku. Ten błyskotliwy pomysł przyniósł im w 2010 roku Nagrodę Nobla. O ile ta metoda sprawdza się perfekcyjnie w laboratorium, jej użycie na większą skalę jest ograniczone. Z tego powodu grono naukowców rozpoczęło pracę nad nowymi metodami wytwarzania grafenu. Obecnie istnieje wiele sposobów, z których najpowszechniejsze i niewątpliwie najłatwiejsze są metody chemiczne, czyli wykorzystujące tlenek grafenu. O nim szerzej opowiem za chwilę.
Rodzina grafenu ciągle się powiększa. Obecnie wyróżniamy już grafen dwu– i trójwarstwowy, redukowany tlenek grafenu, grafan oraz fluorografen. A to i tak dopiero wierzchołek góry lodowej.
I tak powstał SpongeGrafen…
Grafen to pojedyncza płaszczyzna atomów węgla, czyli tzw. materiał dwuwymiarowy. Zabawa z grafenem nie musi jednak się ograniczać tylko do cienkich i płaskich materiałów. Okazuje się, że w odpowiednich warunkach płaszczyzny grafenu mogą połączyć się i uporządkować, tworząc trójwymiarową strukturę w postaci gąbki lub pianki, zawierającą puste w środku przestrzenie, czyli pory. I tu zaczyna się bajka, którą opowiadam od ponad roku…
Do syntezy takiej gąbki wykorzystuję wcześniej wspomniany tlenek grafenu, czyli utlenione pojedyncze arkusze grafenu. Materiał ten wytwarzam w laboratorium łatwą i znaną od dawna
w literaturze metodą Hummersa. Do tego celu używam grafitu w postaci rozdrobnionych płatków. Można też wykorzystać łatwo dostępny grafit z ołówka lub grafit naturalny, które należałoby najpierw rozdrobnić np. papierem ściernym i utrzeć w moździerzu na drobny miał. Jest to ważne, gdyż dzięki temu w kolejnych etapach reakcji może się utlenić jak największa powierzchnia grafitu. Do utlenienia używam prostych chemikaliów dostępnych w każdym laboratorium. Najpierw płatki grafitowe w zlewce łączę dokładnie z nadmanganianem potasu, a następnie kropla po kropli dodaję mieszaninę stężonych kwasów siarkowego (VI) i fosforowego (V). Staram się robić to bardzo powoli, gdyż reakcja jest silnie egzotermiczna – wydziela się dużo ciepła, co przejawia się szybkim ogrzaniem zlewki. Zazwyczaj więc zlewkę umieszczam w innym naczyniu zawierającym lód. Całość mieszam z użyciem mieszadła magnetycznego i zostawiam na noc, aby reakcja zaszła jak najdokładniej. Lekko podgrzewam całość do około 40°C. Następnego dnia zastaję w zlewce zielonkawą pastę, do której dolewam wody destylowanej oraz wody utlenionej (ta z apteki nadaje się świetnie). Zawiesina znów paruje i ogrzewa się, więc pozwalam jej ostygnąć. Jeśli zmienia kolor na żółtobrązowy, oddycham z ulgą, gdyż jest to dla mnie znak, że reakcja zaszła prawidłowo.
Następnym krokiem jest oddzielenie ciała stałego (czyli tlenku grafitu) od cieczy – robię to za pomocą wirówki – oraz odmycie wodą destylowaną, aby zneutralizować jego kwaśny odczyn. Użycie w kolejnym etapie ultradźwięków pozwala na całkowite rozsunięcie płaszczyzn tlenku grafitu; powstaje zawiesina tlenku grafenu. Umieszczam więc fiolkę z tlenkiem grafitu w myjce ultradźwiękowej i pozwalam urządzeniu na wykonanie za mnie całej pracy przy żmudnym oddzielaniu od siebie warstw jedna po drugiej. Rysunek 1 przedstawia zdjęcie płatków grafitowych (po lewej) oraz zawiesiny tlenku grafenu (po prawej).
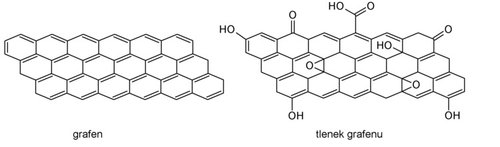
Tlenek grafenu to nic innego jak grafen, na powierzchnię którego podczas reakcji wprowadzono tlenowe grupy funkcyjne. Są to proste grupy znane z lekcji chemii, np. hydroksylowe –OH, karboksylowe –COOH czy karbonylowe –C=O (zobacz Rysunek 2). Dzięki nim odległości między warstwami węglowymi zwiększają się, co ułatwia odseparowanie pojedynczych płaszczyzn. Grupy te powodują jednak zmianę hybrydyzacji atomów węgla z sp2 na sp3, co skutkuje słabym przewodnictwem elektrycznym tlenku grafenu (jest on izolatorem). Aby otrzymać grafen, należy więc te grupy usunąć, czyli zredukować tlenek grafenu. Do wyboru jest wiele metod, których nie będę tutaj dokładnie opisywać, skupię się zaś na jednej z nich – czyli metodzie hydrotermalnej, która pozwala na uzyskanie materiału grafenowego w postaci trójwymiarowych gąbek.
No to do dzieła! Do zawiesiny tlenku grafenu wsypuję odrobinę kwasu askorbinowego (czyli witaminy C), który dodatkowo wspomaga redukcję. Metoda hydrotermalna oznacza reakcję w podwyższonej temperaturze oraz pod zwiększonym ciśnieniem. Z tego powodu fiolkę z tlenkiem grafenu szczelnie zamykam i podgrzewam na płycie grzejnej do 90°C przez 3 godziny. W tym czasie następuje redukcja tlenku grafenu z jednoczesnym zorganizowaniem się grafenowych płatków w czarną strukturę o formie walca, zawierającą we wnętrzu cząsteczki wody. Naukowcy nazywają ją pianką, hydrożelem bądź też gąbką (ang. sponge). Kiedy po trzech godzinach wracam do laboratorium, w fiolce – zamiast żółtawej cieczy – znajduję (z wciąż niesłabnącym podziwem) grafenową gąbkę.
I w ten oto sposób w Centrum Nanotechnologii Politechniki Gdańskiej rodzi się SpongeGrafen.
Co, jak i dlaczego?
Geneza narodzin naszego bohatera nie jest skomplikowana, choć kryje się w niej dużo fizyki i chemii. Jak już wyjaśniłam, tlenek grafenu to grafen udekorowany grupami funkcyjnymi zawierającymi tlen. Grupy te odpowiadają za hydrofilowy charakter zawiesiny. Oznacza to tyle, że tlenek grafenu bardzo dobrze łączy się z wodą, w przeciwieństwie do grafenu, który jest hydrofobowy – on z kolei „nie lubi” wody. Zapamiętajmy to i przejdźmy dalej.
Podczas redukcji hydrotermalnej tylko część grup zostaje usunięta, redukcja w tym przypadku nigdy nie jest stuprocentowa. Należy więc pamiętać, iż to, co otrzymujemy, nie jest czystym grafenem, ale materiałem, który zwykło się nazywać redukowanym tlenkiem grafenu (nazwy „grafen” używam dla uproszczenia). Te resztkowe grupy tlenowe są jednak bardzo potrzebne, gdyż łączą się wiązaniami (wodorowymi) z cząsteczkami wody i dzięki temu pułapkują ją między warstwami grafenu. Podczas redukcji następuje również zmiana charakteru zawiesiny z hydrofilowego na hydrofobowy. W wyniku tego płatki grafenu znów zlepiają się ze sobą pod wpływem tzw. oddziaływań van der Waalsa. Te, a także inne, odrobinę bardziej złożone siły powodują, iż cała konstrukcja trzyma się kupy i powstająca gąbka chłonie wodę po same brzegi. Oddziaływania te, mimo że są bardzo słabe, w takich układach odgrywają kluczową rolę.
Dalsze losy SpongeGrafenu
Od razu nasuwa się pytanie: gdzie nasz bohater znajdzie swoje miejsce i do czego się w życiu nadaje? Odpowiedzi należy szukać po dogłębnym przeanalizowaniu zalet, jakie bez wątpienia posiada.
Po pierwsze, jak na gąbkę przystało, SpongeGrafen ma wewnątrz wiele pustych przestrzeni, czyli porów. Pory te mają rozmiary rzędu mikro-, a nawet nanometrów, czyli są bardzo malutkie. Charakteryzuje się też bardzo dobrymi właściwościami elektrycznymi (jest przewodnikiem elektryczności). Oprócz tego gąbka jest lekka i co również ważne – niedroga
w produkcji. Wszystkie te zalety razem powodują, że SpongeGrafen można wykorzystać do budowy elektrod w wielu urządzeniach, m.in. w bateriach, superkondensatorach czy ogniwach paliwowych. Tym samym mógłby on w przyszłości zastąpić stosowane obecnie materiały węglowe, tj. węgiel szklisty lub pręty grafitowe.
Mnie zaś interesuje głównie to, jak SpongeGrafen sprawdziłby się jako bioelektroda w bioogniwach paliwowych. Urządzenia te działają w ten sposób, że wytwarzają prąd na drodze reakcji chemicznych zachodzących na bioanodzie i biokatodzie. Jako paliwo wykorzystują biopaliwo np. glukozę oraz tlen, w które bogate są m.in. płyny ustrojowe i krew człowieka. Funkcję katalizatorów, czyli „przyspieszaczy” reakcji pełnią enzymy. Takie bioogniwo może więc służyć jako źródło prądu w małych urządzeniach, które można by wszczepić do organizmu człowieka. Paliwo potrzebne do podtrzymania reakcji czerpałoby ono z naszego ciała. Całe szczęście, że SpongeGrafen jest całkowicie biokompatybilny, czyli nieszkodliwy dla zdrowia.
Wróćmy na moment do porowatości. Ze względu na dużą ilość wolnej przestrzeni wewnątrz materiału, jego całkowita powierzchnia jest bardzo duża. Oznacza to, że do powierzchni grafenowej można przyłączyć więcej cząsteczek, niż gdyby to zrobić na takim samym materiale, ale bez porów. A o to mi właśnie chodzi. Dzięki dużej powierzchni właściwej (czyli powierzchni całkowitej przeliczonej na gram materiału) i dużej ilości dostępnych porów, gąbki grafenowe są w stanie zaadsorbować (przyłączyć) na swojej powierzchni więcej enzymów. Większa ilość enzymów przekłada się na zwiększoną konwersję biopaliwa (czyli redukcję tlenu na biokatodzie bądź utlenianie glukozy na bioanodzie). Co za tym idzie takie bioogniwo jest w stanie wytworzyć więcej prądu potrzebnego do zasilania małych urządzeń, np. rozruszników serca. Bardzo dobre przewodnictwo elektryczne grafenu powoduje, że przepływ elektronów w układzie z porowatą elektrodą jest o wiele sprawniejszy. Jak pokazują wyniki przeprowadzonych badań, otrzymywane gęstości prądów są w istocie większe. Co więcej, poprzez odpowiednią modyfikację chemiczną powierzchni grafenu można sprawić, że enzym będzie trzymał się elektrody chętniej i dłużej, co ma ogromny wpływ na stabilność i czas życia takiego ogniwa. Powyższe wyniki zdecydowanie przemawiają na korzyść nowoczesnych elektrod opartych na grafenie i są dla mnie motywacją do wytężonej pracy w laboratorium.
SpongeGrafen nieustannie domaga się bycia ulepszanym i badanym. Prace nad poprawą jego właściwości mechanicznych, czyli odporności na zniszczenie, a także ujednolicenie rozmiaru powstających porów, są obecnie w trakcie realizacji. Materiał można wzmocnić, stosując dodatkowe związki np. polimery. Rozmiar porów może być natomiast kontrolowany za pomocą kulistych cząstek, które dodaje się do fiolki podczas reakcji, a na koniec usuwa chemicznie. Jest więc dla SpongeGrafenu nadzieja i światełko w tunelu. Oby tylko żył długo i szczęśliwie!




Komentarze
Tylko artykuły z ostatnich 12 miesięcy mogą być komentowane.