Jak poprawić funkcjonowanie naczyń krwionośnych w cukrzycy?
Cukrzycę uważa się obecnie za epidemię XXI wieku. Mimo to niewielu z nas zdaje sobie sprawę z zagrożenia zarówno zapadnięcia na tę chorobę, jak i jej powikłań. Według danych WHO ponad 180 milionów osób na całym świecie choruje dziś na cukrzycę, a liczba ta ma się podwoić przed rokiem 2030. Szokujące jest również zestawienie tych danych z epidemią malarii (250 mln chorych) czy HIV/AIDS (33 mln). Koszty społeczne i ekonomiczne cukrzycy są ogromne i w dalszym ciągu będą rosnąć. Zapadamy na tę chorobę między innymi z powodu złych nawyków żywieniowych: jadamy coraz obficiej i rezygnujemy z owoców oraz warzyw na rzecz wysokokalorycznych potraw. Nie bez znaczenia jest również drastyczne ograniczenie aktywności fizycznej wielu z nas na rzecz użytkowania pojazdów mechanicznych czy rozrywki przed szklanym ekranem.
Sytuację dodatkowo utrudnia podstępność cukrzycy, zwłaszcza jej częstszego typu 2, która przez dłuższy okres może przebiegać skrycie, nie dając uciążliwych symptomów. Prawdopodobnie nawet 50 proc. chorych jest tego nieświadomych, a objawy, takie jak senność czy osłabienie, uważają oni za wyraz zwykłego przemęczenia. Tymczasem w ich organizmie dochodzi do przewlekłej hiperglikemii, czyli podwyższonego stężenia glukozy we krwi. Ma ona niekorzystny wpływ na metabolizm wielu typów komórek w całym organizmie. Szczególne miejsce wśród nich zajmują komórki śródbłonka naczyniowego, które cienką warstwą wyścielają od wewnątrz ścianę naczyń krwionośnych. Są one bezpośrednio narażone na ciągły kontakt z glukozą w surowicy, co prowadzi do upośledzenia ich niektórych szlaków metabolicznych i w konsekwencji nieprawidłowego funkcjonowania. Prowadzi to do wielu powikłań w różnych miejscach układu naczyniowego, począwszy od dużych naczyń serca aż po najmniejsze naczynia włosowate. Nadmiar glukozy skutkuje nadprodukcją wolnych rodników, uszkadzających m.in. śródbłonek naczyń serca, nerek czy siatkówki.
Wpływ EPC na kondycję naczyń
Śródbłonek ma jednak wyjątkowe zdolności do naprawy i regeneracji dzięki grupie wyspecjalizowanych komórek nazwanych komórkami progenitorowymi śródbłonka (ang. endothelial progenitor cells, EPC). Są to komórki rezydujące w szpiku kostnym, uwalniane z niego w odpowiedzi na sygnał z uszkodzonego miejsca organizmu. Docierają one z prądem krwi do najmniejszych nawet kapilar i aktywnie włączają się w proces odbudowy uszkodzonego śródbłonka. EPC mają zarówno zdolność wbudowywania się w ściany naczyń, jak i pośrednio poprzez produkcję czynników wzrostowych stymulują regenerację komórek sąsiednich. Jednakże u chorych na cukrzycę komórki progenitorowe nie działają tak sprawnie, jak u ludzi zdrowych, gdyż podwyższony poziom glukozy jest toksyczny także dla nich. Wykazano, że pacjenci z hiperglikemią mają nie tylko mniej EPC w porównaniu z osobami zdrowymi, ale również wielokierunkowe działanie tych komórek jest osłabione. Mimo licznych badań nad tym zagadnieniem naukowcy nadal nie są pewni, dlaczego tak wiele funkcji EPC jest upośledzonych w cukrzycy.
W prowadzonych przez nasz zespół badaniach w Zakładzie Biotechnologii Medycznej Wydziału Biochemii, Biofizyki i Biotechnologii Uniwersytetu Jagiellońskiego, przy współpracy z firmą Adamed, postanowiliśmy zbadać wpływ podwyższonego stężenia glukozy na biologię mysich komórek progenitorowych śródbłonka. Chcemy również ocenić, jaki wpływ na funkcjonowanie tych komórek mają leki przeciwcukrzycowe. Nie wystarczy bowiem wiedzieć, jak cukrzyca oddziałuje na EPC. Kluczowa wydaje się być odpowiedź na pytanie, jakie mechanizmy odpowiadają za te zmiany, ponieważ ich poznanie może się przyczynić do opracowania celowanej, skutecznej terapii przeciwko rozwojowi powikłań cukrzycy.
Nasz model badawczy
Dużym problemem w pracy naukowej jest pozyskanie odpowiedniego materiału badawczego, zwłaszcza jeśli chodzi o komórki czy tkanki człowieka. Populacja ludzka jest bardzo zróżnicowana genetycznie, cechuje ją wolna przemiana pokoleń, nie wspominając już o licznych ograniczeniach natury etycznej. Kolejny problem to pozyskanie wielu próbek. Przytoczone ograniczenia skłoniły nas do wykorzystania zwierzęcego modelu cukrzycy typu 2. Wykorzystywane przez nas myszy poprzez odpowiednio prowadzoną selekcję są do siebie bardzo zbliżone genetycznie i oczywiście łatwo się rozmnażają, a co za tym idzie eksperymenty z ich udziałem są powtarzalne i wiarygodne. Są to równocześnie znakomite „modele” cukrzycy typu 2 u ludzi. Posiadają defekt genetyczny w postaci niefunkcjonalnego receptora leptyny, hormonu sytości produkowanego przez komórki tkanki tłuszczowej. U zdrowych, najedzonych myszy komórki wydzielają leptynę, która krążąc we krwi po związaniu się ze swoim receptorem przekazuje do mózgu sygnał o zakończeniu pobierania pokarmu. Natomiast u myszy o nazwie db/db na skutek uszkodzenia receptora leptyna nie może działać. Dlatego myszy db/db cechuje ogromny apetyt i rozwija się u nich otyłość, a następnie hiperlipidemia i hiperglikemia, prowadząc do pełnoobjawowej cukrzycy.
Należy pamiętać, że choroba występująca w dobrym modelu zwierzęcym musi charakteryzować się takim samym pochodzeniem i symptomami, jak choroba, na którą cierpią ludzie. Również w odpowiedzi na leczenie organizm myszy powinien zachowywać się tak, jak chorego pacjenta. Te wszystkie wymagania spełniają myszy db/db, które wykorzystujemy, badając wpływ cukrzycy i wybranych leków przeciwcukrzycowych na komórki progenitorowe śródbłonka.
Upośledzona funkcja EPC
Powikłania cukrzycy najprościej można podzielić na ostre i przewlekłe. Te pierwsze, (hypoglikemia, kwasica ketonowa), chociaż bardzo groźne i potencjalnie nawet śmiertelne, dają o sobie dość szybko znać i, co za tym idzie, umożliwiają podjęcie leczenia. Cukrzyca typu 2 jednak sporadycznie doprowadza do nich w początkowym stadium, równocześnie w podstępny sposób, generując rozwój przewlekłych powikłań. Stwierdzono, że chorzy na cukrzycę 3-4 razy częściej zapadają na choroby układu krążenia, takie jak choroba wieńcowa czy choroba naczyń obwodowych, skutkująca nefropatią, neuropatią czy retinopatią. Dzięki pracy wielu badaczy wiadomo dziś, że źródłem tych komplikacji jest dysfunkcja śródbłonka spowodowana hiperglikemią. Jednak najbardziej interesuje nas odpowiedź na pytanie, jakie mechanizmy są odpowiedzialne za pogorszenie funkcjonowania EPC w cukrzycy.
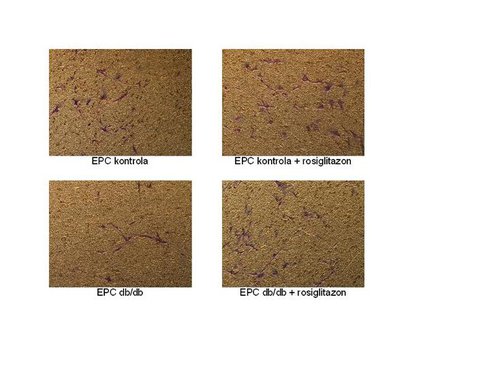
Szukając odpowiedzi na te pytania zaplanowaliśmy w naszym laboratorium cykl eksperymentów. W pierwszej kolejności izolujemy komórki progenitorowe śródbłonka ze szpiku kostnego myszy i hodujemy je w odpowiednich warunkach. Na rycinie przedstawiono przykładowy widok hodowanych przez nas EPC (Ryc. 1). Ponieważ komórki progenitorowe śródbłonka pełnią swoje fizjologiczne funkcje w bardzo niesprzyjających warunkach – w miejscach uszkodzeń oraz urazów – wydaje się oczywiste, że im większa ich żywotność, szczególnie w warunkach stresowych, tym lepiej. Dlatego analizowaliśmy odporność EPC na stres oksydacyjny i stwierdziliśmy, że po dodaniu wolnego rodnika – nadtlenku wodoru – komórki wyizolowane z organizmów myszy chorych na cukrzycę charakteryzowała większa śmiertelność niż komórki z myszy kontrolnych, czyli zdrowych. Również po zadziałaniu na powyższe komórki podwyższonym stężeniem glukozy obserwowaliśmy analogiczne wyniki. Co ciekawe, nadmiar cukru pogarszał także inne funkcje EPC, takie jak zdolność do migracji czy do oddziaływania z sąsiednimi komórkami.
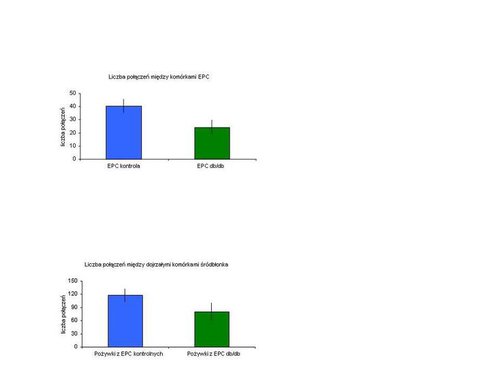
Mierząc liczbę połączeń międzykomórkowych – połączeń, które są konieczne do tworzenia w późniejszym etapie nowych naczyń – stwierdziliśmy, że hiperglikemia obniża potencjał EPC do ich tworzenia. Komórki progenitorowe śródbłonka ze zdrowych myszy formowały o 40 proc. więcej kapilar niż te z myszy „cukrzycowych” (Ryc. 2a). W innym teście okazało się, że nie tylko bezpośrednie działanie EPC jest pogorszone, ale również ich zdolność do stymulacji sąsiednich komórek za pomocą różnego rodzaju przekaźników. EPC z myszy db/db produkowały mniej czynników wzrostowych i tym samym słabiej stymulowały tworzenie połączeń międzykomórkowych przez dojrzałe komórki śródbłonka. Tym razem różnice między komórkami kontrolnymi i izolowanymi z myszy db/db były trochę mniejsze – zaobserwowaliśmy spadek o 30 proc. (Ryc. 2b).
Nasze badania starają się także wykazać, jak tiazolidinediony – grupa leków zwiększająca oddziaływanie insuliny na komórki – wpływają na funkcjonowanie EPC izolowanych z myszy zdrowych i chorych na cukrzycę. U myszy leczonych rosiglitazonem – lekiem używanym do leczenia cukrzycy, należącym do grupy tiazolidinedionów – zaobserwowaliśmy spadek stężenia glukozy we krwi, a migracja EPC izolowanych z tych zwierząt uległa poprawie. Dodatkowo dodanie rosiglitazonu na 24 godziny do hodowli EPC z myszy cukrzycowych zwiększało ich migrację aż do poziomu komórek kontrolnych (Ryc. 3). Komórki progenitorowe śródbłonka izolowane z myszy db/db leczonych rosiglitazonem były również bardziej odporne na stres oksydacyjny niż EPC z myszy chorych nieleczonych.
Na podstawie powyższych przykładów można wnioskować, że rosiglitazon poprawił funkcjonowanie komórek progenitorowych śródbłonka. Obserwowane przez nas zmiany: bardziej efektywna migracja, mniejsza śmiertelność czy większy potencjał tworzenia nowych naczyń przez EPC są obiecujące i mogą przyczynić się do lepszej kondycji naczyń krwionośnych u pacjentów chorych na cukrzycę.
Kolejny etap naszych badań to próba wskazania, jakie mechanizmy molekularne bezpośrednio odpowiadają za te zmiany. Mamy nadzieję, że trwająca obecnie analiza transkryptomu – czyli całego mRNA odpowiedzialnego za powstawanie białek – komórek EPC z myszy db/db i z myszy kontrolnych pozwoli nam znaleźć odpowiedź na to pytanie.
Nadzieje na przyszłość
Jak widać, badania nad funkcjonowaniem komórek progenitorowych śródbłonka mogą doprowadzić do dalszego rozwoju leczenia cukrzycy, ze szczególnym uwzględnieniem zapobiegania jej odległym powikłaniom. Im wydajniej działają EPC, tym lepsze jest funkcjonowanie śródbłonka, ograniczając rozwój uszkodzeń w małych i dużych naczyniach.
Mamy nadzieję, że już wkrótce będzie można wykorzystać właściwości komórek progenitorowych śródbłonka do nowych terapii.



Komentarze
Tylko artykuły z ostatnich 12 miesięcy mogą być komentowane.